Bioquímica
martes, 19 de abril de 2016
lunes, 18 de abril de 2016
Introducción a la bioquímica
Volver
La bioquímica es el estudio de las moléculas y las reacciones químicas de la vida. Es la disciplina que emplea los principios y el lenguaje de la química a fin de explicar la biología a nivel molecular. Los bioquímicos descubrieron que los compuestos químicos y los procesos metabólicos centrales son los mismos que se encuentran en organismos tan distantes como las bacterias, plantas y humanos. Se sabe que los principios básicos de la bioquímica son comunes a todos los organismos vivos. Aunque en la práctica los científicos concentran sus esfuerzos de investigación en organismos particulares, sus resultados se pueden extrapolar a muchas otras especies. Este libro se ha titulado Principios de bioquímica debido a que se enfoca en los conceptos más importantes y fundamentales de la bioquímica: aquellos que son comunes a la mayoría de las especies, incluidas bacterias, plana grupos particulares de organismos y mamíferos como el hombre. Cuando sea conveniente, se indicarán las características que distinguen
Los elementos químicos de la vida
Existen seis elementos no metálicos oxígeno, carbono, hidrógeno, nitrógeno, fósforo y azufre que representan más de 97% del peso de la mayoría de los organismos. Todos estos elementos pueden formar enlaces covalentes estables. Las cantidades relativas de estos seis elementos varían en cada organismo. El agua es el principal componente de las células y representa un alto porcentaje (en peso) de oxígeno. El carbono es mucho más abundante en los organismos vivos que en el resto del universo. Por otro lado, algunos elementos como el silicio, el aluminio y el hierro son muy comunes en la corteza terrestre pero están presentes en las células sólo en trazas. En conjunto, un total de 29 elementos diferentes se encuentran por lo común en los organismos vivientes. Éstos incluyen a cinco iones esenciales en todas las especies: calcio potasio , sodio , magnesio y cloruro . Obsérvese que los 24 elementos adicionales representan sólo 3% del peso de los organismos vivos.
Muchas macromoléculas importante polímeros
Las estructuras químicas constituyen el vocabulario de la bioquímica. Se presentan algunas de estas estructuras a fin de preparar al lector para los ejemplos que encontrará en los siguientes capítulos. Gran parte de la bioquímica estudia moléculas muy grandes a las que se refiere como macromoléculas. Por lo general, las macromoléculas biológicas forman un polímero creado mediante la unión de muchas moléculas orgánicas más pequeñas, o monómeros, por medio de condensaciones.
A. Proteínas
Son veinte los aminoácidos comunes que forman parte de las proteínas de todas las células. Cada aminoácido contiene un grupo amino y un grupo carboxilato, así como una cadena lateral (grupo R) que es única para cada aminoácido. Durante la síntesis de una proteína, el grupo amino de un aminoácido y el grupo carboxilato de otro se condensan para formar un enlace amida. La unión entre el átomo de carbono de un residuo de aminoácido y el átomo de nitrógeno del siguiente residuo se denomina enlace peptídico. La unión de extremo a extremo de muchos aminoácidos forma un polipéptido lineal que puede contener cientos de residuos de aminoácido. Una proteína funcional puede ser un solo polipéptido, o puede estar compuesta por varias cadenas de polipéptidos diferentes que están unidas fuertemente para formar una estructura más compleja
B. Polisacáridos
Los carbohidratos, o sacáridos, están compuestos principalmente por carbono, oxígeno e hidrógeno. Este grupo de componentes incluye azúcares simples (monosacáridos) así como sus polímeros (polisacáridos). Todos los monosacáridos y los residuos de los polisacáridos contienen varios grupos hidroxilo y son por tanto polialcoholes. La mayoría de los monosacáridos comunes contiene ya sea cinco o seis átomos de carbono.
C. Ácidos nucleicos
Los ácidos nucleicos son grandes macromoléculas compuestas por monómeros llamados nucleótidos. El término polinucleótido constituye una descripción más exacta de una sola molécula de ácido nucleico, tal como polipéptido es un término más preciso que proteína para las moléculas individuales compuestas por residuos de aminoácidos. El término ácido nucleico se refiere al hecho de que estos polinucleótidos se detectaron por primera vez como moléculas acídicas en el núcleo de las células eucarióticas. Ahora se sabe que los ácidos nucleicos no están confinados a los núcleos eucarióticos y que son abundantes en el citoplasma y en los procariotas, que no tienen núcleo.
D. Lípidos y membranas
El término “lípido” se refiere a una clase diversa de moléculas ricas en carbono e hidrógeno pero que contienen relativamente pocos átomos de oxígeno. La mayor parte de los lípidos no es soluble en agua, pero se pueden disolver en algunos solventes orgánicos. Los lípidos más simples son los ácidos grasos, que son hidrocarburos de cadena larga con un grupo carboxilato en un extremo. De manera habitual los ácidos grasos se encuentran formando parte de moléculas más largas denominadas glicerofosfolípidos, los cuales contienen glicerol 3-fosfato y dos grupos grasos acilo. Los glicerofosfolípidos son los principales componentes de las membranas biológicas.

La célula es la unidad básica de la vida
Todos los organismos vivos están formados por células, y en general se acepta que ningún organismo es un ser vivo si no consta al menos de una célula. Algunos organismos microscópicos, como bacterias y protozoos, son células únicas, mientras que los animales y plantas están formados por muchos millones de células organizadas en tejidos y órganos. Aunque los virus y los extractos acelulares realizan muchas de las funciones propias de la célula viva, carecen de vida independiente, capacidad de crecimiento y reproducción propios de las células y, por tanto, no se consideran seres vivos. La biología estudia las células en función de su constitución molecular y la forma en que cooperan entre sí para constituir organismos muy complejos, como el ser humano. Para poder comprender cómo funciona el cuerpo humano sano, cómo se desarrolla y envejece y qué falla en caso de enfermedad, es imprescindible conocer las células que lo constituyen. Características generales de las células Hay células de formas y tamaños muy variados. Algunas de las células bacterianas más pequeñas tienen forma cilíndrica de menos de una micra o µm (1 µm es igual a una millonésima de metro) de longitud. En el extremo opuesto se encuentran las células nerviosas, corpúsculos de forma compleja con numerosas prolongaciones delgadas que pueden alcanzar varios metros de longitud (las del cuello de la jirafa constituyen un ejemplo espectacular). Casi todas las células vegetales tienen entre 20 y 30 µm de longitud, forma poligonal y pared celular rígida.”
Células Procarióticas
Por lo general los procariotas son organismos unicelulares. De todos los organismos vivos el que mejor se ha estudiado es la bacteria Escherichia coli. Este organismo ha servido durante medio siglo como un modelo de sistema biológico y muchas de las reacciones bioquímicas que se describen más adelante en este libro fueron descubiertas por primera vez en la E. coli. A pesar de que la E. coli es una especie de bacteria muy típica, algunas bacterias son tan diferentes de la misma como los humanos lo son de las flores y los insectos. Gran parte de esta diversidad es aparente sólo a escala molecular. Los procariotas se han encontrado en casi todos los ambientes concebibles en la Tierra, desde fuentes de agua térmica sulfurosa, por debajo del lecho oceánico y hasta en el interior de células más grandes. Representan una cantidad importante de la biomasa de la Tierra. A pesar de sus diferencias, los procariotas comparten varias características. Carecen de núcleo, su ADN está compactado en una región citoplasmática denominada región nucleoide.
Células Eucarióticas
Los eucariotas incluyen plantas, animales, hongos y protistas. Los protistas son en su mayoría organismos pequeños y unicelulares que no encajan en alguna de las demás clases. Junto con las bacterias, estos cuatro grupos componen los cinco reinos de la vida de acuerdo con un esquema de clasificación popular. Otros esquemas conservan los cuatro reinos eucarióticos pero dividen a las bacterias en eubacterias y arqueobacterias. Las células eucarióticas están rodeadas por una membrana plasmática única, a diferencia de las bacterias que por lo general disponen de una membrana doble. La más obvia de las características que distinguen a los eucariotas de los procariotas es el núcleo circundado por membrana en los eucariotas donde se localizan los cromosomas. Por lo general las células eucarióticas son más grandes que las células bacterianas, de manera habitual unas 1000 veces mayores en volumen. En consecuencia, se requieren estructuras internas y mecanismos complejos para la rápida transportación y comunicación tanto al interior de la célula como hacia y desde el medio externo. Una malla de fibras proteínicas denominada citoesqueleto se extiende a través de toda la célula y contribuye a la formación celular y a la administración del tráfico intracelular. Casi todas las células eucarióticas contienen compartimientos internos circunscritos por membranas llamados organelos. Las funciones específicas de los organelos se vinculan en forma estrecha con las propiedades y estructuras físicas. No obstante, una cantidad importante de procesos bioquímicos específicos ocurren en el citosol. De hecho, más adelante se estudiará en este capítulo que el citosol, al igual que los organelos, probablemente esté altamente organizado.
a) Célula animal b) Célula Vegetal
La Célula
Partes y Funciones de la Célula
click
Actividades
1) Identificar las partes y funciones de la célula.
2) Estudiar y conocer conceptos básicos de este capitulo para una mayor comprensión del libro.
Volver
El agua
Volver
La vida en la Tierra se suele describir como un fenómeno basado en el carbono, pero sería igualmente correcto llamarlo un fenómeno basado en el agua. Es probable que la vida se haya originado en el agua, hace más de tres mil millones de años, y que todas las células vivientes sigan dependiendo del agua para existir. En la mayor parte de las células el agua es la molécula más importante y forma de 60 a 90% de su masa , aunque hay pocas excepciones, como las semillas y las esporas, de las cuales se expulsa el agua. Las semillas y las esporas pueden permanecer latentes por largos periodos hasta “revivir” por la reintroducción de agua.Conceptos clave
- En una molécula de agua, el átomo de oxígeno y los átomos de hidrógeno comparten electrones en enlaces covalentes, pero la división no es igual.
- En la unión covalente entre el oxígeno e hidrógeno, el átomo de oxígeno atrae electrones con un poco más de fuerza que los átomos de hidrógeno.
- La división desigual de electrones le brinda a la molécula de agua una carga levemente negativa cerca de su átomo de oxígeno y una carga ligeramente positiva cerca de sus átomos de hidrógeno.
- Cuando una molécula neutra tiene un área positiva en un extremo y un área negativa en la otra, es una molécula polar.
- Las moléculas de agua se atraen entre sí según la atracción entre el extremo positivo de una molécula de agua y el extremo negativo del otro.
La molécula de agua es polar
.jpg) La polaridad de una molécula depende tanto de la polaridad de sus enlaces covalentes como de su geometría. La disposición angulada de los enlaces polares O—H del agua produce un dipolo permanente para toda la molécula, como muestra. Una molécula de amoniaco también contiene un dipolo permanente. Así, aun cuando el agua y el amoniaco gaseoso son eléctricamente neutros, ambas moléculas son polares. La gran solubilidad de las moléculas polares de amoniaco en el agua se ve facilitada por fuertes interacciones con las moléculas polares del agua. La solubilidad del amoniaco en el agua demuestra el principio de que “lo semejante disuelve a lo semejante”. No todas las moléculas son polares; por ejemplo, el dióxido de carbono también contiene enlaces covalentes polares pero están alineados entre ellos y con orientación opuesta, por lo que las polaridades se anulan entre sí.
La polaridad de una molécula depende tanto de la polaridad de sus enlaces covalentes como de su geometría. La disposición angulada de los enlaces polares O—H del agua produce un dipolo permanente para toda la molécula, como muestra. Una molécula de amoniaco también contiene un dipolo permanente. Así, aun cuando el agua y el amoniaco gaseoso son eléctricamente neutros, ambas moléculas son polares. La gran solubilidad de las moléculas polares de amoniaco en el agua se ve facilitada por fuertes interacciones con las moléculas polares del agua. La solubilidad del amoniaco en el agua demuestra el principio de que “lo semejante disuelve a lo semejante”. No todas las moléculas son polares; por ejemplo, el dióxido de carbono también contiene enlaces covalentes polares pero están alineados entre ellos y con orientación opuesta, por lo que las polaridades se anulan entre sí.¿Que tan importante puede ser el agua? ¿Sabes porque el agua es importante?
Importancia Biológica del Agua
El agua es el elemento más
importante para la vida en la Tierra. El 70 por ciento del planeta está formado
por agua. A su vez, el ser humano y la mayoría de animales están constituidos
por un 70 por ciento de agua, y las propias células de nuestro interior, en un
70 por ciento están compuestas por agua. La molécula de agua (H2O) tiene
forma de ( V ) y el ángulo entre los dos enlaces covalentes O—H es de 104.5°.
Algunas propiedades importantes del agua se deben a la forma angulada y a los
enlaces intermoleculares que puede formar.
Puentes de hidrógeno en el agua
Una de las consecuencias importantes de la polaridad de
la molécula de agua es que di- chas moléculas se atraen entre sí.
El agua, elemento vital y esencial, sustancia que esta
formada por puentes de hidrogeno, donde estos son mas efectivos que en algunas
otras moléculas. En su molécula los electrones que intervienen en sus enlaces
están mas cerca del oxigeno que de los hidrógenos y por esto generan dos cargas
parciales negativas en el extremo donde esta el oxigeno y dos cargas parciales
positivas en el extreme donde se encuentra los hidrógenos lo que los puentes de
hidrógenos sean de importancia fundamental para la vida sobre la tierra, porque
todas los seres vivos requieren amientes acuoso también juega un papel
fundamental en el ADN y ARN.


La importancia de los puentes de hidrógenos es mas bien
la especificidad que otorgan a la molécula y a todos los procesos en los que se
ve implicado algún tipo de ácido nucleico, como en la replicación o la
transcripción de ARN
El agua es un solvente excelente
Las propiedades físicas del agua se combinan para hacerla
un excelente solvente. Ya se estudió que las moléculas de agua son polares;
esta propiedad ejerce consecuencias im- portantes, como se verá después. El
agua puede separar el soluto polar y puede disolver muchas sustancias diversas.
Por supuesto, esta característica es vital para las reacciones que se dan en el
cuerpo humano y en el cuerpo del resto de seres vivos ya que la mayoría de
reacciones bioquímicas solo se dan dentro de soluciones acuosas.
El Agua juega un papel
muy importante en el sistema biológico con respecto a la Presión osmótica porque
Si una membrana permeable al solvente separa a dos soluciones que contienen
concentraciones distintas de sustancias disueltas, o solutos, las moléculas del
solvente se di- fundirán desde la solución menos concentrada hacia la más
concentrada en un proceso llamado ósmosis. La presión necesaria para
evitar este flujo de solvente se llama presión osmótica. La presión
osmótica de una solución depende de la concentración molar total del soluto y
no de su naturaleza química.
En las células vivas, las
membranas permeables al agua separan al citosol del medio externo. Las
composiciones de las soluciones intracelulares son bastante distintas de las de
las soluciones extracelulares, y unos compuestos se concentran más y otros
menos dentro de las células. En general, las concentraciones de los
solutos dentro de la célula son mucho mayores que sus concentraciones en el
ambiente acuoso fuera de la célula. Las moléculas de agua tienden a atravesar
la membrana celular para entrar a la célula y diluir
1. La viscosidad del citoplasma es mayor que la del agua, lo que se debe a la presencia de numerosos solutos, como los azúcares. De acuerdo con mediciones recientes parece que la viscosidad del citoplasma sólo es un poco mayor que la del agua, aun en los organelos empacados densamente.
2. Las moléculas con carga se enlazan momentáneamente entre sí dentro de las células y ello restringe su movilidad. Dichas consecuencias de la unión ejercen un efecto pequeño, pero apreciable, sobre las tasas de difusión.
3. Los choques con moléculas de agua inhiben la difusión a causa de un efecto que se denomina hacinamiento molecular. Es la principal razón por la que se desacelera la difusión en el citoplasma.
A. Las sustancias iónicas y polares se disuelven en agua
El agua puede interactuar y disolver otros compuestos polares y compuestos que se ionizan.La ionización se relaciona con la ganancia o pérdida de un electrón, que da lugar a un átomo o a un compuesto que presenta una carga neta. Las moléculas que se pueden disociar y formar iones se llaman electrólitos. Las sustancias que se disuelven con facilidad en agua se llaman hidrofílicas o amantes del agua.B. Concentraciones celulares y difusión
El interior de una célula puede estar muy apretado, como sugieren los dibujos de Goodsell. El comportamiento de los solutos en el citoplasma es distinto del que tienen en una sencilla solución en agua. Una de las diferencias más importantes es la reducción de la velocidad de difusión dentro de las células. Hay tres razones por las que los solutos se disuelven con más lentitud en las células.1. La viscosidad del citoplasma es mayor que la del agua, lo que se debe a la presencia de numerosos solutos, como los azúcares. De acuerdo con mediciones recientes parece que la viscosidad del citoplasma sólo es un poco mayor que la del agua, aun en los organelos empacados densamente.
2. Las moléculas con carga se enlazan momentáneamente entre sí dentro de las células y ello restringe su movilidad. Dichas consecuencias de la unión ejercen un efecto pequeño, pero apreciable, sobre las tasas de difusión.
3. Los choques con moléculas de agua inhiben la difusión a causa de un efecto que se denomina hacinamiento molecular. Es la principal razón por la que se desacelera la difusión en el citoplasma.
Ionización del agua. ácidos y bases.
Los ácidos débiles y las bases débiles cuando se
disuelven en agua alteran las cantidades relativas de estos iones en la
disolución, bien aportando iones hidrógeno por disociación si son ácidos, o
bien retirándolos por protonación si son bases. Por ello, dado que muchos procesos
biológicos se ven afectados por las concentraciones de iones hidrógeno e hidroxilo, es conveniente que prestemos ahora atención a la ionización del agua
y de los ácidos y bases débiles disueltos en ella.
La Escala de pH
Existen varios procesos bioquímicos, como el transporte de oxigeno en la sangre, la catálisis de reacciones con enzimas y la generación de energía metabólica durante la respiración o fotosíntesis que están influidos por la concentración de protones
Soluciones amortiguadoras para resistir cambios de pH
Soluciones amortiguadoras para resistir cambios de pH Si el pH de una solución permanece casi constante cuando se agregan pequeñas cantidades de ácido o base fuerte, se dice que la solución está regulada o amortiguada. La capacidad de una solución para resistir cambios de pH se llama capacidad de amortiguación Al repasar las curvas de titulación del ácido acético y del ácido fosfórico se ve que la regulación más efectiva, representada por la región de pendiente mínima en la curva, se presenta cuando las concentraciones de un ácido débil y su base conjugada son iguales; en otras palabras, cuando el pH es igual al pKa. El intervalo efectivo de amortiguación por una mezcla de ácido débil y su base conjugada se suele considerar desde una unidad de pH abajo hasta una unidad de pH arriba del pKa.
Ejemplo
Propiedades Fisicas y Quimicas del Agua
Click
Fuerzas intermoleculares y Puentes de Hidrógenos
Actividades
1) Las cadenas laterales de algunos aminoácidos poseen grupos funcionales que forman puentes de hidrógeno en soluciones acuosas con facilidad. Dibuje los puentes de hidrógeno que probablemente se formen entre el agua y las siguientes cadenas laterales de aminoácido:
2)Indique si cada uno de los compuestos siguientes es polar, si es anfipático y si se disuelve fácilmente en el agua.
Volver
Los aminoácidos y la estructura primaria de las proteínas
Volver
El estudio de las proteínas ha ocupado a los bioquímicos durante más de un siglo. Comprender las composiciones, formas tridimensionales y actividades químicas de estas biomoléculas puede ser la clave para acometer algunos de los desafíos científicos más apremiantes. Por ejemplo, el proceso de la fotosíntesis es una de las rutas bioquímicas más importantes, por su papel en la captación de la energía solar. Un examen estructural detallado de las numerosas proteínas que efectúan la fotosíntesis está permitiendo comprender este proceso fundamental.Estructura general de los Aminoácidos
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos comunes, estándar o normales. A pesar de la poca cantidad de los aminoácidos, se puede obtener una variedad enorme de distintos polipéptidos al unir los 20 aminoácidos comunes para formar distintas combinaciones. Los aminoácidos se llaman así porque son derivados aminados de ácidos carboxílicos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido
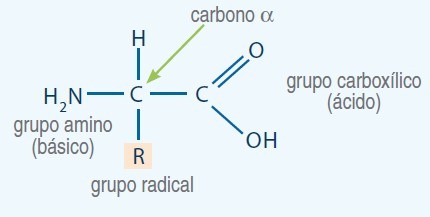
Clasificación de los grupos R de los aminoácidos
A. Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral. Los dos átomos de hidrógeno del carbono a de la glicina imparten poco carácter hidrofóbico a la molécula. Después habrá oportunidad de comprobar que la glicina desempeña un papel único en la estructura de muchas proteínas porque su cadena lateral es lo bastante pequeña como para tener cabida en nichos en los que a otros aminoácidos les resultaría imposible hacerlo.
Hay cuatro aminoácidos: alanina (Ala, A), valina (Val, V), leucina (Leu, L) y el isómero estructural de la leucina, isoleucina (Ile, I), que tienen cadenas laterales alifáticas saturadas. La cadena lateral de la alanina es un grupo metilo, mientras que la valina presenta una cadena lateral ramificada con tres carbonos, y la leucina y la isoleucina contienen una cadena lateral ramificada de cuatro carbonos cada una. Los átomos de carbono a y b de la isoleucina son asimétricos. Ya que la isoleucina tiene dos centros quirales, posee cuatro estereoisómeros posibles. El estereoisómero que presentan las proteínas se denomina L-isoleucina, y el aminoácido que difiere en el carbono a se llama L-aloisoleucina . Los otros dos estereoisómeros son la D-isoleucina y la D-aloisoleucina.
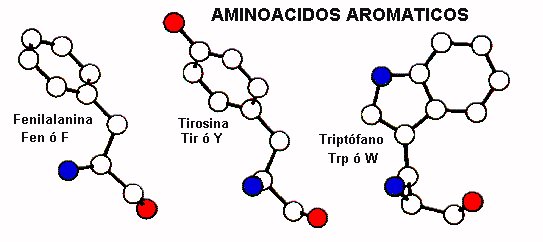
B. Grupos R aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromáticos. En el caso de la fenilalanina es una cadena hidrofóbica bencílica. La tirosina se parece estructuralmente a la fenilalanina; en la tirosina, un grupo hidroxilo sustituye al hidrógeno para de la fenilalanina lo que la convierte en un fenol. El grupo hidroxilo de la tirosina es ionizable, pero bajo condiciones fisiológicas normales retiene su hidrógeno. La cadena lateral del triptófano contiene un grupo indol bicíclico. La tirosina y el triptófano no son tan hidrofóbicos como la fenilalanina porque en sus cadenas laterales hay grupos polares.
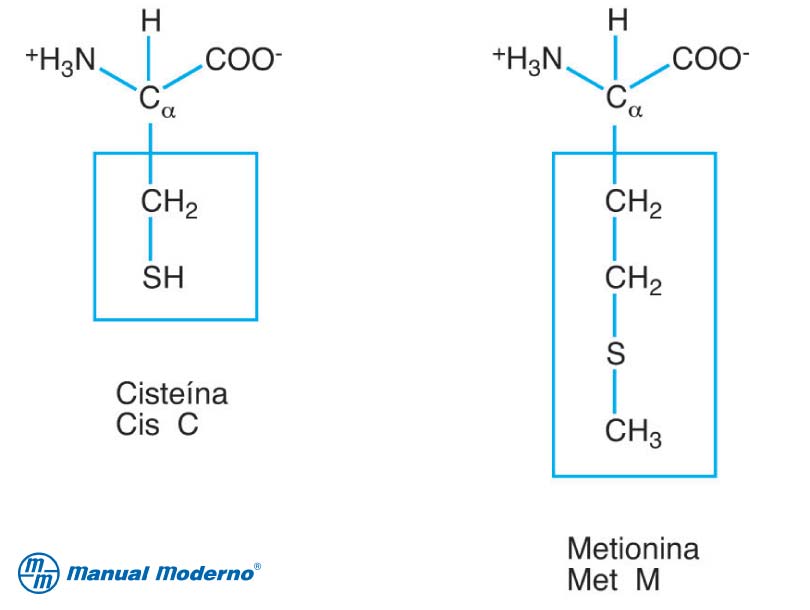
C. Grupos R sulfurados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos. La metionina desempeña un papel especial en la síntesis de proteínas porque casi siempre representa el primer aminoácido en una cadena de polipéptido. La estructura de la cisteína se parece a la de la alanina, con un átomo de hidrógeno reemplazado por un grupo sulfhidrilo Aunque la cadena lateral de la cisteína es algo hidrofóbica, también es muy reactiva.
D. Cadenas laterales con grupos alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas. Además de la cadena lateral fenólica más ácida de la tirosina, los grupos hidroxilo de la serina y la treonina despliegan las propiedades débiles de ionización de los alcoholes primarios y secundarios. El grupo hidroximetilo de la serina (—CH2OH) no se ioniza en forma apreciable en soluciones acuosas; empero, este alcohol puede reaccionar dentro de los sitios activos de varias enzimas como si estuviera ionizado. La treonina, como la isoleucina, cuenta con dos centros quirales, los átomos de carbono a y b. La L-treonina es el único de los cuatro estereoisómeros que se encuentra con frecuencia en las proteínas. (Los otros estereoisómeros son D-treonina, L-alotreonina y D-alotreonina).

E. Grupos R básicos
La histidina (His, H), lisina (Lys, K) y arginina (Arg, R) presentan cadenas laterales hidrofílicas que son bases nitrogenadas y tienen carga positiva a pH 7. La cadena lateral de la histidina contiene un sustituyente de anillo de imidazol. La forma protonada de este anillo se llama ion imidazolio (sección 3.4). La lisina es un diaminoácido y tiene grupos amino a y e al mismo tiempo. El grupo e-amino existe como ion alquilamonio (—CH2 —NH3 ) a pH neutro y confiere una carga positiva a las proteínas. La arginina es el más básico de los 20 aminoácidos porque su cadena lateral de ion guanidinio está protonada bajo todas las condiciones que se encuentran de manera habitual dentro de una célula.
F. Grupos R ácidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7. Además de los grupos carboxilo a, el aspartato posee un grupo carboxilo b y el glutamato un grupo carboxilo g. El aspartato y el glutamato confieren carga negativa a las proteínas porque sus cadenas laterales se encuentran ionizadas a pH 7. A veces se les llama ácido aspártico y ácido glutámico, respectivamente, pero bajo la mayoría de las condiciones fisiológicas se encuentran como bases conjugadas y, al igual que otros carboxilatos, tienen el sufijo ato. Es probable que el glutamato sea conocido bajo la forma de su sal monosódica, el glutamato monosódico (MSG, de monosodium glutamate), que se usa en alimentos como intensificador de sabores. La asparagina (Asn, N) y la glutamina (Gln, Q) son las amidas del ácido aspártico y el ácido glutámico, respectivamente. Aunque las cadenas laterales de la asparagina y la glutamina son eléctricamente neutras, estos aminoácidos son muy polares y se encuentran con frecuencia en las superficies de las proteínas, donde pueden interactuar con moléculas de agua. Los grupos amida polares de la asparagina y la glutamina también pueden formar puentes de hidrógeno con las cadenas laterales de otros aminoácidos polares
Otros aminoácidos y derivados de aminoácido
En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies contienen una diversidad de aminoácidos Los que son precursores de los aminoácidos comunes, o bien son intermediarios en otras rutas bioquímicas. Como ejemplos están la homocisteína, homoserina, ornitina y citrulina. La S-adenosilmetionina (SAM) es un donador común de metilo en muchas rutas bioquímicas. Varias especies de bacterias y de hongos sintetizan D-aminoácidos que se usan en las paredes celulares y en antibióticos peptídicos complejos, como la actinomicina D. Algunos aminoácidos comunes sufren modificaciones químicas para producir aminas con importancia biológica. Se sintetizan con reacciones catalizadas por enzimas, que incluyen descarboxilación y desaminación. Por ejemplo, en el cerebro de los mamíferos, el glutamato se convierte en el neurotransmisor g-aminobutirato (GABA)Técnicas de purificación de las proteínas
Para estudiar determinada proteína en el laboratorio, en general se debe separar de todos
los demás componentes celulares, incluyendo a otras proteínas parecidas. Se pueden aplicar
pocas técnicas analíticas en forma directa a las mezclas crudas de proteínas celulares
porque contienen cientos (o miles) de proteínas diferentes. Los pasos de purificación
son distintos para cada proteína. Se determinan probando con varias técnicas distintas
hasta que se desarrolla un procedimiento que produce en forma repetida proteína altamente
purificada y que conserva su actividad biológica. Los pasos de purificación suelen
aprovechar pequeñas diferencias en las solubilidades, cargas netas, tamaños y especificidades
de unión de las proteínas. En esta sección se describen algunos de los métodos
comunes de purificación de proteínas. La mayor parte de las técnicas de purificación se
lleva a cabo entre 0 y 4°C para minimizar los procesos dependientes de la temperatura,
como la degradación y la desnaturalización (desdoblado) de la proteína.
A continuación se puede usar la cromatografía en columna
Técnicas Analíticas
La electroforesis en gel de poliacrilamida
La electroforesis separa proteínas de acuerdo con su migración en un campo eléctrico.
Determinación de la secuencia de los residuos de aminoácido
El análisis de aminoácidos produce información sobre la composición de una proteína, pero no acerca de su estructura primaria (o secuencia de residuos). Pehr Edman desarrolló, en 1950, una técnica que permite extraer e identificar uno por uno los residuos del N-terminal de una proteína. El procedimiento de degradación de Edman consiste en tratar una proteína a pH 9.0 con PITC, que también se conoce como reactivo de Edman. (Recuérdese que también se puede usar PITC en la medida de los aminoácidos libres. El PITC reacciona con el N-terminal libre de la cadena para formar un derivado de feniltiocarbamoílo, o PTC-péptido. Cuando el derivado de PTC-péptido se trata con un ácido anhidro, como ácido trifluoroacético, el enlace peptídico del residuo N-terminal se rompe en forma selectiva y libera un derivado de anilinotiazolinona del residuo.
Actividades
1. Trace e identifique la estructura estereoquímica de la L-fenilalanina. Indique si es R o S
2. Demuestre que la proyección de Fischer de la forma común de la treonina corresponde a la (2S,3R)-treonina.
5. Para cada una de las siguientes cadenas laterales de aminoácido modificado, identifique al aminoácido a partir del cual se derivó y la clase de modificación química que ha habido.
Volver
Proteínas: Estructura tridimensional y función
Volver
Es posible describir a una proteína como una cadena de aminoácidos unidos por enlaces peptídicos en una secuencia específica. Sin embargo, las cadenas polipeptídicas no sólo son lineales sino que también están dobladas en formas compactas que contienen espirales, regiones en zigzag, giros y asas. Durante los últimos 50 años se han determinado las formas tridimensionales o conformaciones de más de mil proteínas. Una conformación es un ordenamiento espacial de átomos que depende de la rotación de uno o varios enlaces. La conformación de una molécula, como la de una proteína, puede cambiar sin que los enlaces covalentes se rompan, mientras que las diversas configuraciones de una molécula sólo se pueden cambiar si se rompen y vuelven a unir enlaces covalentes. Una proteína puede ser una sola cadena polipeptídica o puede estar formada por varias de esas cadenas unidas entre sí por interacciones débiles. Como regla general, cada cadena polipeptídica es codificada por un solo gen, aunque hay algunas excepciones interesantes a esta regla.
Hay cuatro niveles de estructura de las proteínas
Las moléculas individuales de proteína se pueden describir mediante hasta cuatro niveles de estructura.
La estructura primaria
describe la secuencia lineal de residuos de aminoácidos en una proteína. Recuérdese que las secuencias de aminoácidos siempre se escriben desde el amino terminal (N-terminal) hasta el carboxilo terminal C- (C-terminal). La estructura tridimensional de una proteína se describe con tres niveles adicionales: estructura secundaria, estructura terciaria y estructura cuaternaria. Las fuerzas que mantienen, o estabilizan, estos tres niveles son no covalentes, de manera primordial.
La estructura secundaria
se refiere a las regularidades en las conformaciones locales mantenidas por puentes de hidrógeno entre los hidrógenos de amida y los oxígenos de carbonilo en la columna vertebral del péptido. Las estructuras secundarias principales son las hélices a y las hebras b. Se acostumbra representar las regiones helicoidales a con dibujos que muestran las estructuras de proteínas plegadas; las hebras b se representan con flechas anchas que apuntan desde la dirección N-terminal hacia la C-terminal
La estructura terciaria
describe la cadena polipeptídica totalmente plegada y compactada. Muchos polipéptidos plegados consisten en varias unidades distintas unidas por un tramo corto de residuos de aminoácidos a dichas unidades se les conoce como dominios. Las estructuras terciarias se estabilizan por las interacciones de cadenas laterales de aminoácidos en regiones no vecinas de la cadena polipeptídica. La formación de la estructura terciaria acerca partes lejanas de las estructuras primaria y secundaria.
A. Estructuras supersecundarias
Las estructuras supersecundarias, o motivos, son combinaciones reconocibles de hélices a, hebras b y giros que aparecen en diversas proteínas. A veces los motivos se relacionan con determinada función, aunque los motivos de estructura similar pueden tener funciones distintas en proteínas diferentes.
B. Dominios
Hay muchas proteínas que están formadas por varias unidades compactas, discretas, plegadas en forma independiente llamadas dominios. Los dominios pueden consistir en combinaciones de motivos. El tamaño de un dominio varía desde unos 25 a 30 residuos de aminoácidos hasta más de 300. En la figura 4.20 se muestra un ejemplo de una proteína con varios dominios. Obsérvese que cada dominio es una unidad compacta distinta, que consiste en varios elementos con estructura secundaria. En general, los dominios están unidos por asas, pero también se unen entre sí mediante interacciones débiles formadas por las cadenas laterales de aminoácidos en la superficie de cada dominio.
La estructura cuaternaria
Implica la asociación de dos o más cadenas polipeptídica en una multisubunidad, o proteína oligomérica u oligómera. Las cadenas polipeptídicas de una proteína oligómera pueden ser idénticas o distintas.
1. Los oligómeros suelen ser más estables que sus subunidades disociadas, lo que parece indicar que la estructura cuaternaria prolonga la duración in vivo de una proteína.
2. Los sitios activos de algunas enzimas oligoméricas se forman con residuos procedentes de cadenas de polipéptido adyacentes.
3. Las estructuras tridimensionales de muchas proteínas oligoméricas cambian cuando éstas se unen con ligandos. Tanto las estructuras terciarias de las subunidades como las cuaternarias (es decir, los contactos entre subunidades) se pueden alterar. Algunos cambios son elementos clave en la regulación de la actividad biológica de ciertas proteínas oligoméricas.
4. Proteínas diferentes pueden compartir las mismas subunidades. Como muchas subunidades desempeñan una función definida (por ejemplo, unión con el ligando), la evolución ha favorecido la selección de diferentes combinaciones de subunidades para efectuar funciones relacionadas. Dicha elección es más eficiente que la selección de una proteína monomérica totalmente nueva que duplique parte de la función
1. Los oligómeros suelen ser más estables que sus subunidades disociadas, lo que parece indicar que la estructura cuaternaria prolonga la duración in vivo de una proteína.
2. Los sitios activos de algunas enzimas oligoméricas se forman con residuos procedentes de cadenas de polipéptido adyacentes.
3. Las estructuras tridimensionales de muchas proteínas oligoméricas cambian cuando éstas se unen con ligandos. Tanto las estructuras terciarias de las subunidades como las cuaternarias (es decir, los contactos entre subunidades) se pueden alterar. Algunos cambios son elementos clave en la regulación de la actividad biológica de ciertas proteínas oligoméricas.
4. Proteínas diferentes pueden compartir las mismas subunidades. Como muchas subunidades desempeñan una función definida (por ejemplo, unión con el ligando), la evolución ha favorecido la selección de diferentes combinaciones de subunidades para efectuar funciones relacionadas. Dicha elección es más eficiente que la selección de una proteína monomérica totalmente nueva que duplique parte de la función

Métodos para determinar la estructura de las proteínas
La secuencia de aminoácidos en los polipéptidos, la estructura primari, se puede determinar por métodos químicos, como la degradación de Edman, o en forma indirecta, a partir de la secuencia del gen. La técnica acostumbrada para determinar la conformación tridimensional de una proteína es la cristalografía con rayos X. En esta técnica se apunta un haz de rayos X colimados, o paralelos, a un cristal de moléculas de proteína. Los electrones en el cristal difractan los rayos X, que se registran entonces en una película, o mediante un detector electrónico. El análisis matemático de la figura de difracción produce una imagen de las nubes de electrones que rodean a los átomos en el cristal. Este mapa de densidad electrónica revela la forma general de la molécula y las posiciones de cada uno de los átomos en el espacio tridimensional. Al combinar esos datos con los principios del enlazamiento químico es posible deducir el lugar de todos los enlaces en una molécula y en consecuencia su estructura general.
a) Diagrama de los rayos X difractados por un cristal de proteína b) Difracción de rayos X para un cristal de desoxihemoglobina
Conformación del grupo peptídico
La estructura de las proteínas comienza con la de los enlaces peptídicos, o enlaces de péptido, que unen a los aminoácidos en una cadena polipeptídica. Los dos átomos que intervienen en el enlace peptídico, junto con sus cuatro sustituyentes (el átomo de oxígeno carbonílico, el átomo de hidrógeno de amida y los dos átomos adyacentes de carbono a) constituyen el grupo peptídico.Nótese que el grupo peptídico es polar. El oxígeno carbonílico presenta una carga negativa parcial y puede servir como aceptador de hidrógeno en puentes de hidrógeno. El nitrógeno cuenta con una carga positiva parcial y el grupo —NH puede servir como donador de hidrógeno en puentes de hidrógeno. La deslocalización electrónica y el carácter parcial de enlace doble del enlace peptídico evitan que haya rotación libre en torno al enlace C—N. La conformación del grupo peptídico se restringe a una de dos conformaciones posibles, que puede ser trans o cis.
En la conformación trans, los dos carbonos a de residuos adyacentes de aminoácido están en lados opuestos del enlace peptídico y en las esquinas opuestas del rectángulo que forma el grupo peptídico plano. En la conformación cis, los dos carbonos a están en el mismo lado del enlace peptídico y están más cerca entre sí. Las conformaciones cis y trans se producen durante la síntesis de la proteína, cuando el enlace peptídico se forma uniendo dos aminoácidos a la cadena polipeptídica.
La conformación cis es menos favorable que la conformación trans, que es extendida debido a impedimentos estéricos entre las cadenas laterales unidas a los dos átomos de carbono a. En consecuencia, casi todos los grupos peptídicos en las proteínas tienen la conformación trans. Hay raras excepciones, por lo general en los enlaces que tienen el nitrógeno de amida de la prolina, para el que la conformación cis sólo crea una interferencia estérica un poco mayor que la conformación trans.
La hélice α
La hélice alfa se repite exactamente cada 18 residuos que representan cinco vueltas. Por tanto, tiene 3.6 residuos por vuelta. La elevación de los residuos es de 0.15 nm. Por tanto, el paso de hélice es de 0.54 nm. 3.6 res/vuelta x 0.15 nm/res = 0.54 nm/vuelta. Los aminoácidos espaciados 3 ó 4 lugares en la secuencias quedan muy próximos, mientras que los aminoácidos separados dos lugares quedan en posiciones opuestas de la hélice. La hélice alfa está estabilizada por puentes de hidrógeno entre los grupos amino y carbonilo del esqueleto del polipéptido. El grupo carbonilo de cada residuo forma un puente de hidrógeno con el grupo amino del aminoácido situado cuatro residuos más adelante.
En teoría, una hélice a puede ser una rosca izquierda o derecha. Las hélices a que se encuentran en las proteínas casi siempre son derechas. En una hélice a ideal, el paso es de 0.54 nm, la elevación es de 0.15 nm y la cantidad de residuos de aminoácidos necesaria para una vuelta completa es de 3.6

Hebras b y láminas b
La otra estructura secundaria común se llama estructura b, una clase que incluye a hebras b y láminas b. Las hebras B son partes de la cadena polipeptídica que se encuentran casi totalmente extendidas. Cada residuo en una hebra b ocupa de 0.32 a 0.34 nm de la longitud total, en contraste con la espiral compacta de una hélice a, donde cada residuo corresponde a 0.15 nm de la longitud general. Cuando se ordenan varias hebras b lado a lado forman láminas B, estructura que propusieron originalmente Pauling y Corey cuando desarrollaban el modelo teórico de la hélice a. Las proteínas casi nunca contienen hebras b aisladas porque la estructura en sí no es mucho más estable que otras conformaciones. Sin embargo, las láminas b se hallan estabilizadas por puentes de hidrógenos entre los oxígenos carbonilicos y los hidrógenos de amida en hebras b adyacentes.


Las asas y los giros unen a hélices a y hebras b y permiten que la cadena de polipéptido se doble sobre sí misma para producir la forma tridimensional compacta que se ve en la estructura nativa. Hasta la tercera parte de los residuos de aminoácidos en una proteína típica está formada por esas estructuras no repetitivas. Las asas contienen con frecuencia residuos hidrofílicos y se suelen encontrar en las superficies de las proteínas, donde están expuestas al solvente y forman puentes de hidrógeno con el agua. Como se ve en muchos ejemplos de este capítulo, algunas asas consisten en numerosos residuos de estructura no repetitiva extendida. Más o menos 10% de los residuos se puede encontrar en dichas regiones.
Las asas que sólo contienen pocos (hasta cinco) residuos se llaman giros si causan un cambio abrupto en la dirección de una cadena de polipéptidos. Los tipos más comunes de giros bruscos se llaman giros inversos o giros B porque con frecuencia conectan hebras b antiparalelas diferentes.

Asas y giros
En una hélice a o en una hebra b, los residuos consecutivos tienen una conformación similar que se repite en toda la estructura. También, las proteínas presentan tramos de estructura tridimensional no repetitiva. La mayor parte de esas regiones de estructura secundaria se puede caracterizar como rizos (o asas) y giros (o vueltas) porque causan cambios de dirección en la columna vertebral del polipéptido. Como en las regiones repetitivas, las conformaciones de los grupos peptídicos en las regiones no repetitivas están restringidas. Tienen valores de f y de c que en general están bien en el interior de las regiones permitidas en el diagrama de Ramachandran, y con frecuencia están cerca de los valores de residuos que forman hélices a o hebras b.
Las asas y los giros unen a hélices a y hebras b y permiten que la cadena de polipéptido se doble sobre sí misma para producir la forma tridimensional compacta que se ve en la estructura nativa. Hasta la tercera parte de los residuos de aminoácidos en una proteína típica está formada por esas estructuras no repetitivas. Las asas contienen con frecuencia residuos hidrofílicos y se suelen encontrar en las superficies de las proteínas, donde están expuestas al solvente y forman puentes de hidrógeno con el agua. Como se ve en muchos ejemplos de este capítulo, algunas asas consisten en numerosos residuos de estructura no repetitiva extendida. Más o menos 10% de los residuos se puede encontrar en dichas regiones.
Las asas que sólo contienen pocos (hasta cinco) residuos se llaman giros si causan un cambio abrupto en la dirección de una cadena de polipéptidos. Los tipos más comunes de giros bruscos se llaman giros inversos o giros B porque con frecuencia conectan hebras b antiparalelas diferentes.
Desnaturalización y renaturalización de las proteínas
Los cambios en el ambiente o los tratamientos químicos pueden alterar la conformación nativa de una proteína con la pérdida concomitante de su actividad biológica. Esa alteración se llama desnaturalización. La cantidad de energía necesaria para causar la desnaturalización es pequeña, con frecuencia, quizá la equivalente a la que se necesita para alterar tres o cuatro puentes de hidrógeno. Algunas proteínas pueden desdoblarse por completo cuando están desnaturalizadas y forman una hélice aleatoria (una cadena fluctuante que se considera totalmente desordenada); no obstante, la mayor parte de las proteínas desnaturalizadas conserva una estructura interna considerable. A veces es posible encontrar condiciones bajo las cuales las proteínas desnaturalizadas pueden renaturalizarse, o volverse a plegar, en forma espontánea después de haber estado desnaturalizadas. Las proteínas se suelen desnaturalizar por calentamiento. Bajo condiciones adecuadas, un aumento modesto de temperatura causa el desdoblamiento y pérdida de las estructuras secundaria y terciaria. Un ejemplo de la desnaturalización térmica. En este experimento una solución de ribonucleasa bovina A se calienta con lentitud mientras se vigila la estructura de la proteína mediante diversas técnicas enfocadas en medir los cambios de conformación. Cualquiera de esas técnicas detecta un cambio cuando hay desnaturalización. En el caso de la ribonucleasa A bovina, la desnaturalización térmica también requiere un agente reductor que altere los puentes internos de disulfuro permitiendo que se desdoble la proteína.


Actividades
1. Observe el siguiente tripéptido:
a) Marque los átomos de carbono a y trace cuadros en torno a cada grupo peptídico.
b) ¿Que representan los grupos R?
c) ¿Por qué hay rotación limitada en torno a los enlaces de C O de carbonilo con N de amida?
d) Suponiendo que la estructura química represente la conformación correcta del enlace peptídico, los grupos peptídicos ¿están en la conformación cis o trans?
e) ¿Cuáles enlaces permiten la rotación de grupos peptídicos entre sí?
2. Explique
Por qué los residuos de 1) glicina y 2) de prolina no se encuentran con frecuencia en las hélices a.
Suscribirse a:
Comentarios (Atom)