Volver
El estudio de las proteínas ha ocupado a los bioquímicos durante más de un siglo. Comprender las composiciones, formas tridimensionales y actividades químicas de estas biomoléculas puede ser la clave para acometer algunos de los desafíos científicos más apremiantes. Por ejemplo, el proceso de la fotosíntesis es una de las rutas bioquímicas más importantes, por su papel en la captación de la energía solar. Un examen estructural detallado de las numerosas proteínas que efectúan la fotosíntesis está permitiendo comprender este proceso fundamental.Estructura general de los Aminoácidos
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos comunes, estándar o normales. A pesar de la poca cantidad de los aminoácidos, se puede obtener una variedad enorme de distintos polipéptidos al unir los 20 aminoácidos comunes para formar distintas combinaciones. Los aminoácidos se llaman así porque son derivados aminados de ácidos carboxílicos. En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido
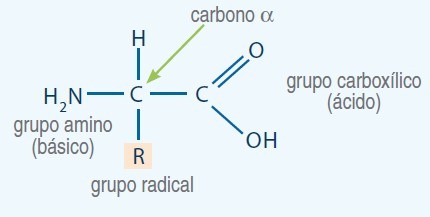
Clasificación de los grupos R de los aminoácidos
A. Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral. Los dos átomos de hidrógeno del carbono a de la glicina imparten poco carácter hidrofóbico a la molécula. Después habrá oportunidad de comprobar que la glicina desempeña un papel único en la estructura de muchas proteínas porque su cadena lateral es lo bastante pequeña como para tener cabida en nichos en los que a otros aminoácidos les resultaría imposible hacerlo.
Hay cuatro aminoácidos: alanina (Ala, A), valina (Val, V), leucina (Leu, L) y el isómero estructural de la leucina, isoleucina (Ile, I), que tienen cadenas laterales alifáticas saturadas. La cadena lateral de la alanina es un grupo metilo, mientras que la valina presenta una cadena lateral ramificada con tres carbonos, y la leucina y la isoleucina contienen una cadena lateral ramificada de cuatro carbonos cada una. Los átomos de carbono a y b de la isoleucina son asimétricos. Ya que la isoleucina tiene dos centros quirales, posee cuatro estereoisómeros posibles. El estereoisómero que presentan las proteínas se denomina L-isoleucina, y el aminoácido que difiere en el carbono a se llama L-aloisoleucina . Los otros dos estereoisómeros son la D-isoleucina y la D-aloisoleucina.
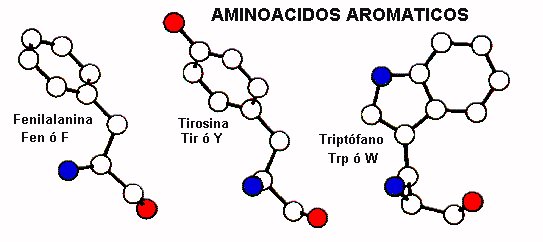
B. Grupos R aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromáticos. En el caso de la fenilalanina es una cadena hidrofóbica bencílica. La tirosina se parece estructuralmente a la fenilalanina; en la tirosina, un grupo hidroxilo sustituye al hidrógeno para de la fenilalanina lo que la convierte en un fenol. El grupo hidroxilo de la tirosina es ionizable, pero bajo condiciones fisiológicas normales retiene su hidrógeno. La cadena lateral del triptófano contiene un grupo indol bicíclico. La tirosina y el triptófano no son tan hidrofóbicos como la fenilalanina porque en sus cadenas laterales hay grupos polares.
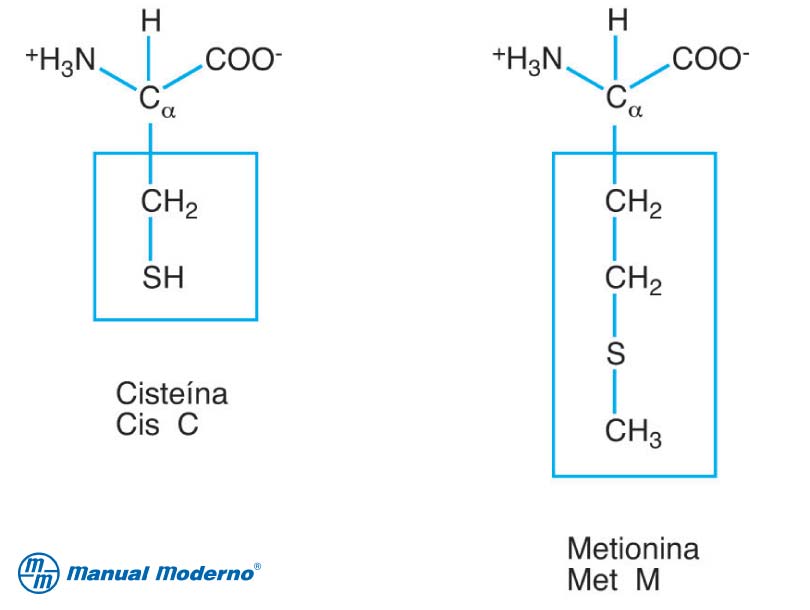
C. Grupos R sulfurados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos. La metionina desempeña un papel especial en la síntesis de proteínas porque casi siempre representa el primer aminoácido en una cadena de polipéptido. La estructura de la cisteína se parece a la de la alanina, con un átomo de hidrógeno reemplazado por un grupo sulfhidrilo Aunque la cadena lateral de la cisteína es algo hidrofóbica, también es muy reactiva.
D. Cadenas laterales con grupos alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas. Además de la cadena lateral fenólica más ácida de la tirosina, los grupos hidroxilo de la serina y la treonina despliegan las propiedades débiles de ionización de los alcoholes primarios y secundarios. El grupo hidroximetilo de la serina (—CH2OH) no se ioniza en forma apreciable en soluciones acuosas; empero, este alcohol puede reaccionar dentro de los sitios activos de varias enzimas como si estuviera ionizado. La treonina, como la isoleucina, cuenta con dos centros quirales, los átomos de carbono a y b. La L-treonina es el único de los cuatro estereoisómeros que se encuentra con frecuencia en las proteínas. (Los otros estereoisómeros son D-treonina, L-alotreonina y D-alotreonina).

E. Grupos R básicos
La histidina (His, H), lisina (Lys, K) y arginina (Arg, R) presentan cadenas laterales hidrofílicas que son bases nitrogenadas y tienen carga positiva a pH 7. La cadena lateral de la histidina contiene un sustituyente de anillo de imidazol. La forma protonada de este anillo se llama ion imidazolio (sección 3.4). La lisina es un diaminoácido y tiene grupos amino a y e al mismo tiempo. El grupo e-amino existe como ion alquilamonio (—CH2 —NH3 ) a pH neutro y confiere una carga positiva a las proteínas. La arginina es el más básico de los 20 aminoácidos porque su cadena lateral de ion guanidinio está protonada bajo todas las condiciones que se encuentran de manera habitual dentro de una célula.
F. Grupos R ácidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7. Además de los grupos carboxilo a, el aspartato posee un grupo carboxilo b y el glutamato un grupo carboxilo g. El aspartato y el glutamato confieren carga negativa a las proteínas porque sus cadenas laterales se encuentran ionizadas a pH 7. A veces se les llama ácido aspártico y ácido glutámico, respectivamente, pero bajo la mayoría de las condiciones fisiológicas se encuentran como bases conjugadas y, al igual que otros carboxilatos, tienen el sufijo ato. Es probable que el glutamato sea conocido bajo la forma de su sal monosódica, el glutamato monosódico (MSG, de monosodium glutamate), que se usa en alimentos como intensificador de sabores. La asparagina (Asn, N) y la glutamina (Gln, Q) son las amidas del ácido aspártico y el ácido glutámico, respectivamente. Aunque las cadenas laterales de la asparagina y la glutamina son eléctricamente neutras, estos aminoácidos son muy polares y se encuentran con frecuencia en las superficies de las proteínas, donde pueden interactuar con moléculas de agua. Los grupos amida polares de la asparagina y la glutamina también pueden formar puentes de hidrógeno con las cadenas laterales de otros aminoácidos polares
Otros aminoácidos y derivados de aminoácido
En los organismos vivos hay más de 200 aminoácidos diferentes. Además de los normales, que están incorporados en las proteínas, todas las especies contienen una diversidad de aminoácidos Los que son precursores de los aminoácidos comunes, o bien son intermediarios en otras rutas bioquímicas. Como ejemplos están la homocisteína, homoserina, ornitina y citrulina. La S-adenosilmetionina (SAM) es un donador común de metilo en muchas rutas bioquímicas. Varias especies de bacterias y de hongos sintetizan D-aminoácidos que se usan en las paredes celulares y en antibióticos peptídicos complejos, como la actinomicina D. Algunos aminoácidos comunes sufren modificaciones químicas para producir aminas con importancia biológica. Se sintetizan con reacciones catalizadas por enzimas, que incluyen descarboxilación y desaminación. Por ejemplo, en el cerebro de los mamíferos, el glutamato se convierte en el neurotransmisor g-aminobutirato (GABA)Técnicas de purificación de las proteínas
Para estudiar determinada proteína en el laboratorio, en general se debe separar de todos
los demás componentes celulares, incluyendo a otras proteínas parecidas. Se pueden aplicar
pocas técnicas analíticas en forma directa a las mezclas crudas de proteínas celulares
porque contienen cientos (o miles) de proteínas diferentes. Los pasos de purificación
son distintos para cada proteína. Se determinan probando con varias técnicas distintas
hasta que se desarrolla un procedimiento que produce en forma repetida proteína altamente
purificada y que conserva su actividad biológica. Los pasos de purificación suelen
aprovechar pequeñas diferencias en las solubilidades, cargas netas, tamaños y especificidades
de unión de las proteínas. En esta sección se describen algunos de los métodos
comunes de purificación de proteínas. La mayor parte de las técnicas de purificación se
lleva a cabo entre 0 y 4°C para minimizar los procesos dependientes de la temperatura,
como la degradación y la desnaturalización (desdoblado) de la proteína.
A continuación se puede usar la cromatografía en columna
Técnicas Analíticas
La electroforesis en gel de poliacrilamida
La electroforesis separa proteínas de acuerdo con su migración en un campo eléctrico.
Determinación de la secuencia de los residuos de aminoácido
El análisis de aminoácidos produce información sobre la composición de una proteína, pero no acerca de su estructura primaria (o secuencia de residuos). Pehr Edman desarrolló, en 1950, una técnica que permite extraer e identificar uno por uno los residuos del N-terminal de una proteína. El procedimiento de degradación de Edman consiste en tratar una proteína a pH 9.0 con PITC, que también se conoce como reactivo de Edman. (Recuérdese que también se puede usar PITC en la medida de los aminoácidos libres. El PITC reacciona con el N-terminal libre de la cadena para formar un derivado de feniltiocarbamoílo, o PTC-péptido. Cuando el derivado de PTC-péptido se trata con un ácido anhidro, como ácido trifluoroacético, el enlace peptídico del residuo N-terminal se rompe en forma selectiva y libera un derivado de anilinotiazolinona del residuo.
Actividades
1. Trace e identifique la estructura estereoquímica de la L-fenilalanina. Indique si es R o S
2. Demuestre que la proyección de Fischer de la forma común de la treonina corresponde a la (2S,3R)-treonina.
5. Para cada una de las siguientes cadenas laterales de aminoácido modificado, identifique al aminoácido a partir del cual se derivó y la clase de modificación química que ha habido.






No hay comentarios.:
Publicar un comentario